포스팅 목차
가장 많이 쓰이는 2차전지인 리튬이온배터리가 어떻게 전기가 발생시키는지 아시나요? 그 원리에 대해 알아보겠습니다. 추가로 강점과 한계, 그리고 대체재가 있는지에 대해서도 함께 알아보도록 하겠습니다.
[ 목차 ]
1. 원소기호 3번 리튬의 특징
전기가 발생한다는 것은 전류가 흐르는 것입니다. 전류가 흐르는 것은 전자가 이동하는 것이고요. 그렇다면 우리는 전기가 필요하니, 전류가 흐르도록 전지를 만들어야 합니다. 전자가 이동해야 되므로, 우리는 전자를 발생시킬 원소를 하나 골라야 합니다. 이 선택된 원소가 바로 "리튬"입니다.

왜 리튬일까요? 리튬은 위의 주기율표에서 원소기호 3번으로 가볍고 부피가 작습니다. 주기율표에서 숫자가 작을수록 원자가 작고 전자밀도가 높습니다. 감이 오시나요? 스마트폰이나 노트북과 같은 휴대용 전자제품을 사용하려면 배터리가 작고 용량이 커야 합니다. 아무리 용량이 커도 배터리가 크면 휴대성이 없어지니까요. 1세대 2차전지인 납축전지로 휴대성 전자제품을 만들 수 없던 이유죠. 리튬은 에너지 전위가 높고 부피가 작고 가볍기 때문에 우리가 원하는 작고 강한 배터리를 만들 수 있게 해 줍니다. 이러한 전지의 탄생으로 전자제품계의 혁명이 시작되었고, 이런 리튬이온배터리 모델을 개발하고 상용화하는데 기여한 과학자들은 2019년에 노벨상을 받게 되었습니다.


2. 전기의 발생은 전자의 이동
그럼 이제 리튬으로 어떻게 전자를 이동시킬까요? 우선 전자가 이동해야 하니 음극과 양극이 필요합니다. 리튬이 편안하게 머무는 공간이 양극이고, 리튬이 불안하게 머무는 공간이 음극입니다. 불안한 리튬들은 편안해지고 싶어 합니다. 그래서 리튬이온과 전자는 모두 음극에서 양극으로 이동합니다. 이때 우리는 양이온과 음이온이 이동하는 경로를 구분해 줘야 합니다. 우리가 필요한 전기는 "전자의 이동"이기 때문입니다.
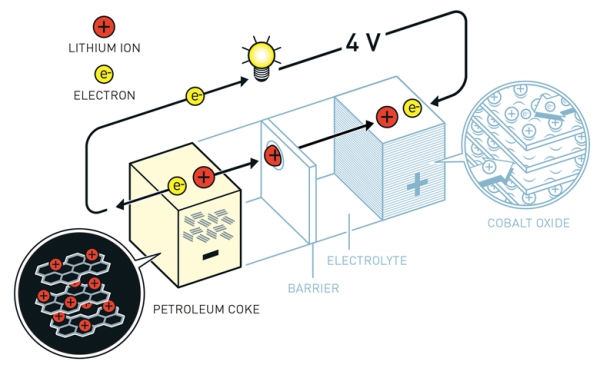
1) 리튬 양이온의 이동통로인 전해질
리튬 전자를 따로 이동시키기 위해 리튬양이온을 이동하는 경로를 먼저 세팅해 줍니다. 바로 전해질(전해액)입니다. 이 이온 전도도가 높은 물질인 전해액은 리튬이온은 이동하게 해 주면서, 전자는 이동하지 못하게 해 줍니다. 리튬 양이온은 이제 음극에서 양극으로 전해질을 통해 이동할 수 있게 되었습니다. 그럼 전자만 남게 되겠지요?
2) 전자는 도선을 통해 이동하여 전기를 발생
전자는 전해질 때문에 꼼짝없이 음극에 머물면서 불안정상태에 있습니다. 그럼 이제 우리는 전자들을 위해 통로를 하나 열어줍니다. 바로 도선입니다. 음극과 양극을 도선으로 이어줍니다. 그럼 전자들은 이 도선을 타고 양극으로 이동하면서 전류를 발생시킵니다. 이제 스마트폰을 사용하고, 노트북을 사용하고, 전기차를 사용할 수 있게 됩니다.


3. 충전은 양극에서 음극으로의 이동
우리가 전기를 사용합니다. 리튬이온과 전자들은 계속적으로 음극에서 양극으로 이동합니다. 그러다가 모든 리튬이온과 전자들이 양극으로 이동하게 됩니다. 이것을 우리는 방전이라고 부릅니다. 전기를 모두 사용한 것이죠. 그럼 이제 전기를 다시 사용할 수 있도록 충전을 해야 합니다.
충전의 경로는 방전과 반대입니다. 양극에 머물러 있는 편안한 상태의 리튬을 다시 음극으로 보내야 합니다. 그런데 얘들이 알아서 음극으로 갈까요? 그렇지 않습니다. 편안한 곳에서 불편한 곳으로 갈 리 없죠. 그래서 우리는 외부에서 "충전"이라는 강제성을 부여해야 합니다. 외부 기전력을 줘서 리튬들을 강제로 음극으로 보냅니다. 그럼 다시 리튬원자는 음극에서 불안한 형태로 있게 되고, 우리가 필요할 시 다시 전자를 이동시키는 방전을 통해 전기를 얻을 수 있게 됩니다.
4. 배터리 성능을 좌우하는 양극재
리튬이온이 안정된 상태에 있는 공간이 양극입니다. 즉 양극이 리튬의 공급원이 되는 것인데요, 양극재를 어떻게 만드는지에 따라 배터리의 성능이 달라집니다.

위의 표는 우리나라의 2차전지 대표기업 중 하나인 POSCO에서 발췌한 표입니다. 우리나라는 삼원계 배터리라고 해서, 니켈-코말트-망간으로 구성된 NCM 배터리를 사용합니다. 여기에서 언급된 원소들이 바로 양극재를 이루는 원소들입니다. 위의 표에서 언급한 니켈, 코발트, 망간, 알루미늄을 어떻게 조합하냐에 따라 차량의 성능이 달라지게 됩니다. 우리가 "에너지밀도"에 집중할 것인지, "수명"에 집중할 것인지, "출력"에 집중할 것인지에 따라 구성되는 원소비율이 조금씩 달라지며, 그에 따라 가격도 달라지게 되겠죠? 성능과 수명, 그리 안정성의 밸런스를 잡고, 가격을 적정하게 책정하느냐 따라 제조사의 경쟁력이 결정되게 됩니다.
요새 가장 많이 사용되는 양극재 소재를 살펴보겠습니다.
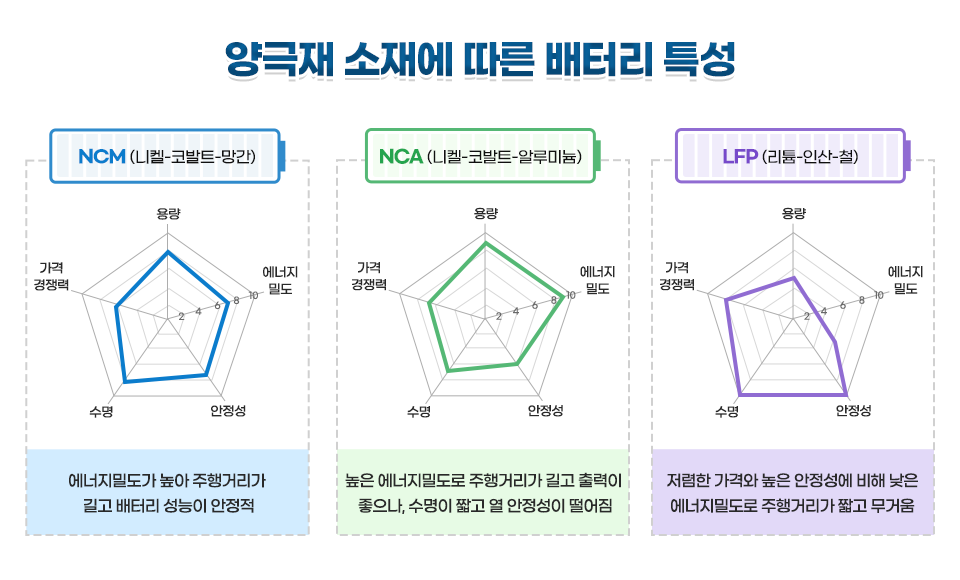
우리나라는 앞서 말씀드린 것처럼 NCM, NCA 배터리를 주력으로 삼아 성능에 주력을 두고 있습니다. 반대로 요새 아주 핫한 중국 배터리 회사인 CATL은 리튬, 인산, 철로 구성된 LFP 배터리를 주력으로 삼고 있습니다. 무엇이 좋고 나쁘고를 정하기는 어렵습니다. 각자의 특징이 있고 그것을 선택하는 것은 구매자의 몫이니까요. 다만 현재도 배터리의 연구는 활발히 지속되고 있고, 현재의 경쟁구도는 어느 날 갑자기 바뀔 수도 있다는 것입니다.
5. 리튬이온배터리의 수명
"메모리효과"라고 들어보셨나요? 우리가 스마트폰을 사용하다 보면, 배터리가 점점 빨리 닳는 것을 체감하게 됩니다. 배터리의 완충된 용량이 적어지는 건데요. 충전지를 완전 방전되기 전에 재충전을 하면 전기량이 남아 있음에도 충전기가 완전 방전으로 기억하는 효과를 가지게 됩니다. 그래서 최초에 가지고 있던 충전용량보다 용량이 줄어들면서 충전지 수명이 줄어들게 되는 것이죠. 이것은 양극 전극으로 니켈(Ni)을 사용하는 니켈-카드뮴 이차전지에 해당하는 문제입니다.
즉, 메모리효과가 없습니다. 그렇기에 수명이 다른 충전지보다 길다는 강점이 있는 것이죠. 따라서 혹시나 아직도 "아! 완전 방전 후 배터리를 충전해야 오래써!" 라고 생각하시는 분들은 이제 그렇게 하지 않으셔도 됩니다. 오히려 완전 방전은 고장을 일으키는 원인이 될 수도 있기 때문에, 수시로 충전해 주시는 게 좋습니다.
그럼 리튬이온배터리의 수명은 어떻게 될까요? 사용처에 따라 조금씩 달라질 테니 전기차량에 사용되는 배터리를 기준으로 말씀드리겠습니다. 전기차 배터리 수명은 평균적으로 완충한다고 가정하였을 때에, 1000회~2000회 정도라고 합니다. 이것은 전기차 충전을 어느 정도 했느냐에 따라 수명이 달라진다는 의미인데요. 대략적으로 2000회 충전 후 사용 가능할 때의 주행거리는 대략 40만 km 정도이며, 한국 에너지공단에서는 수명을 약 10년이라고 추정하고 있습니다.
물론 제조사와 전기차량 사용자의 관리방법과 충전습관에 따라 차이가 많이 날 수도 있다고 합니다만, 최대 21년까지도 사용할 수 있다고 하는데요.
생각해 보면 21년 동안 차를 탄다는 것은 흔한 일이 아니죠? 어쩌면 전기차를 사용하는 동안 배터리 교체를 한 번도 하지 않을 수도 있겠습니다. 저 같은 경우는 15년 타면 다른 차를 타고 싶은 마음이 가득 찰 것 같습니다. 여러분들은 어떠신가요?
6. 한계점과 대체재인 "해수전지"
완벽해 보이는 리튬이온배터리이지만 이 역시 한계를 가지고 있습니다. 무엇인지 간단히 살펴보겠습니다.
- 유기 전해액의 발화성 : 한번 불이 나면 화재진압이 어렵고, 연쇄화재로 번질 수 있습니다. (뉴스에서 몇 번 보셨죠?)
- 자원의 희소성 : 핵심 원소인 리튬, 코발트 등은 희귀한 금속으로 매장량이 한정되어 있습니다. 따라서 결국에는 모두 소모하고 없어질 자원이죠. 그만큼 경쟁력도 커서 전기차량의 가격이 쉽게 싸질 수 없는 이유이기도 합니다.
- 금속 채굴 및 공정에 따른 가격비용과 환경오염 : 희귀 금속을 채굴하고, 배터리에 사용될 수 있도록 다양한 공정을 거치게 되는데요. 여기서 많은 에너지가 소모되고, 환경이 파괴되기도 합니다.
- 리튬 폐전지의 환경오염 : 리튬 폐전지는 장기간 방치될 경우 공해물질을 발생하여 환경오염을 유발합니다. 이 폐배터리를 활용하는 방안도 많이 연구되고 있죠.
그럼 리튬이온배터리의 "리튬"을 대체할 것으로 주목받고 있는 것이 무엇일까요? 바로 "나트륨(Na)"입니다. 네 맞습니다. 여러분들이 잘 아시는 "소금"입니다. 바닷물에 아주 많이 있는 자원이죠. 이 나트륨을 이용하는 "해수전지"가 한창 연구가 진행 중입니다. 나트륨은 리튬과 같은 알칼리 계열의 원소이기에 비슷한 화학적 성질을 가집니다. 주기율표 11번으로 리튬보다는 상대적으로 무겁지만, 가벼운 원소에 해당합니다. 무엇보다 지구에 막대한 양이 있다는 게 가장 큰 경쟁력입니다.
해수전지의 구동원리 자체는 리튬이온배터리와 비슷합니다. 양극재가 바닷물이 되는 것이고, 나트륨이 이동하면서 충전과 방전을 반복하는 것이죠. 자연 바닷물을 사용하기 때문에 친환경적이고, 자원이 무한하다 보니 기술만 갖추게 되면 가격은 매우 저렴할 것으로 보입니다. 그렇게만 된다면 전기차도 지금보다 많이 저렴해지지 않을까요? 해수전지는 나중에 별도의 포스팅으로 다루어보겠습니다.

오늘은 이렇게 이차전지에 대해 알아보았습니다. 여러분들의 2차전지에 대한 지식에 조금이나마 도움이 되었으면 좋겠습니다. 오늘도 길고 부족한 글 읽어주셔서 감사합니다. 좋은 하루 보내세요!
# 함께 보면 좋은 글
전기차 배터리 원자재와 생산량 순위
안녕하세요! 오늘은 전기차 배터리 중에서도 보편적으로 사용되는 리튬이온배터리를 만들기 위해 필요한 중요한 원자재에 대해서 알아보려고 합니다. 그럼 시작해 보겠습니다. 1. 리튬 (Lithium,
somipapa.com
전기차 배터리 폼팩터와 테슬라 4680 원통형 배터리
안녕하세요! 오늘은 테슬라의 주력 배터리인 "원통형 배터리"에 대해 알아보려고 합니다. 전기차 배터리에 대한 많은 연구가 진행되면서 현재는 각형, 파우치형, 원통형의 삼파전이 이뤄지고 있
somipapa.com



